
İnsanlık var olduğu günden beri gördüğü ve hatta görmediği ama var olduğunu hissettiği şeyleri çözmeye çalışır. Gördüklerimizi ve gördüğümüz büyük şeyleri yani uzayı anlamlandırmaya başlarken bazı bilim insanları ve felsefeciler göremediğimiz kadar küçük şeylere odaklandılar. Buradaki yazımızda detaylarıyla anlattığımız gibi bu küçük şeyler atomlardı ve atomlar hakkındaki ilk düşünceler milattan önce 5. yüzyılda başladı.
Binlerce yıl boyunca pek çok farklı bilim insanı ve felsefeci, kendilerine göre atom modelleri geliştirdi. Şüphesiz eksiklikleri olsa da bunlardan en ilginci Rutherford atom modelidir. Çünkü bu model, Dünyamızın da içinde bulunduğu Güneş sistemine bir hayli benziyor. Gelin Rutherford atom modeli nedir biraz daha yakından inceleyerek özelliklerini ve eksikliklerini görelim.
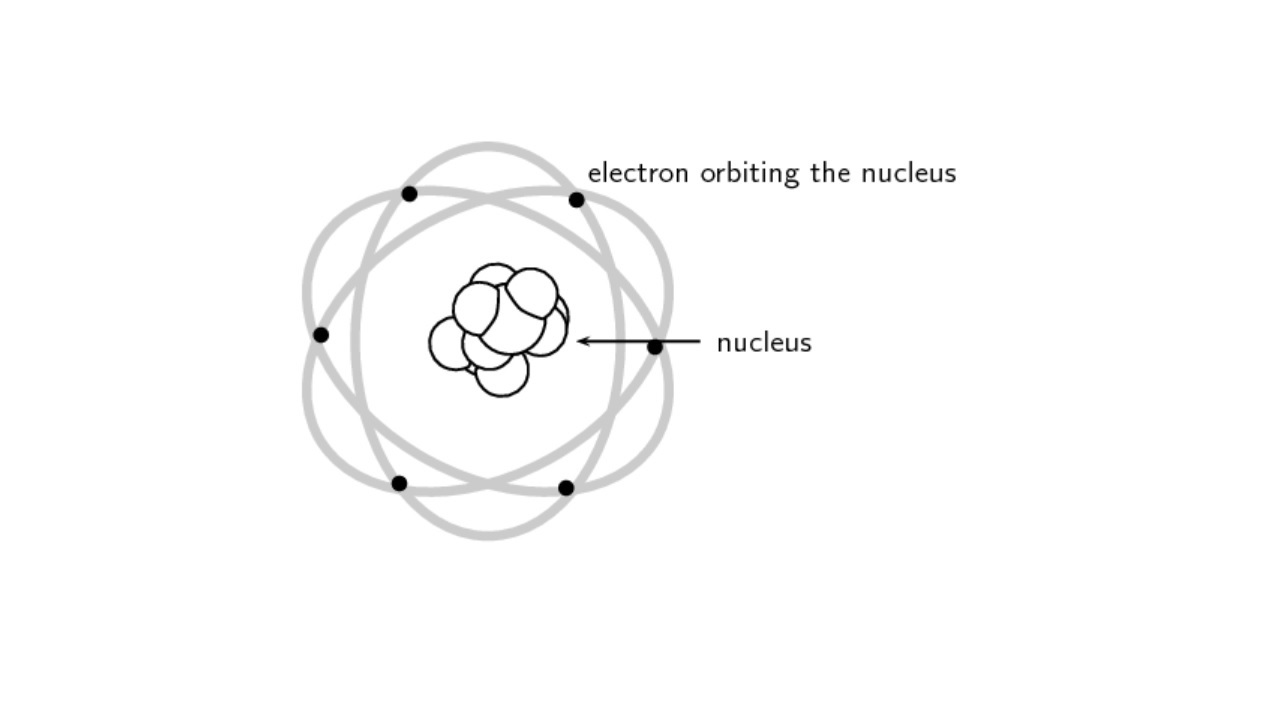
Rutherford atom modeli nedir?
Rutherford atom modeli, 1911 yılında Yeni Zelandalı - İngiliz deneysel fizikçi Ernest Rutherford tarafından ortaya atılan bir fiziksel bir atom modelidir. 1908 Nobel Kimya Ödülü sahibi olan Rutherford, uyguladığı deney sonuçları üzerinde yaptığı incelemeler neticesinde atom hakkında bu fiziksel modeli ortaya çıkarmıştır.
Ernest Rutherford ile aynı dönem pek çok bilim insanı atom üzerine çalışmış ve farklı atom modelleri ortaya koymuştur. Rutherford atom modelinin de benzer modeller gibi oldukça eksiği vardır ancak kabul etmek gerekiyor ki Rutherford atom modeli, Bohr atom modelinin ve Modern Atom Teorisinin temellerini atmıştır.
Rutherford atom modeli nasıl ortaya çıktı?

Zaten yıllardır atom üzerine çalışmalar yapan Ernest Rutherford, bir gün yeni bir deney daha yapmaya karar verdi. Bu deneyde Rutherford, bir tabakaya tanecikler gönderecek ve hareketlerini gözlemleyecekti. Bu deneyde kullanılacak tabaka altın, tanecikler ise pozitif yüklü olacaktı.
Deney günü geldiği zaman Rutherford, arkasına film yerleştirilmiş altın bir tabaka hazırladı. He+2 olarak gösterilen +2 pozitif yüklü alfa tanecikleri bu tabakaya doğru gönderdi. Işınlar levhaya çarptıkça Ernest Rutherford izledikleri yolu ve çarpma etkilerini inceledi. İncelemeler sonucu elde ettiği veriler ilginçti ve ortaya Rutherford atom modeli çıktı.
Rutherford atom modeli özellikleri:

Ernest Rutherford, yaptığı deney sonucu atomun çapını o döneme göre oldukça az kabul edilecek bir farkla hesaplamayı başardı. Altın tabakaya gönderilen 22 bin pozitif yüklü alfa tanecikten sapan yalnızca biriydi. Sapma olması normal kabul ediliyor çünkü 20. yüzyılın ilk yıllarından bahsediyoruz.
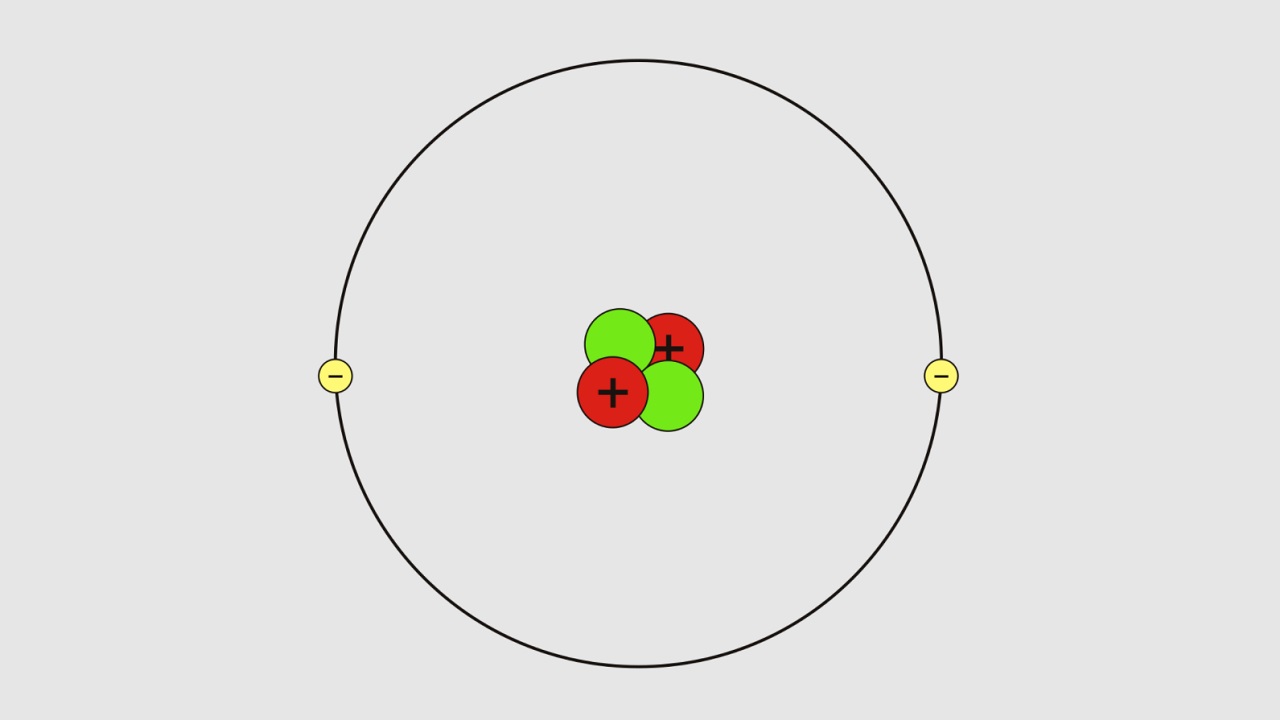
Ernest Rutherford gözlemleri sonucu atomun tıpkı Güneş Sistemi gibi olduğu iddasını ortaya attı. Buna göre atomun çekirdeği pozitif proton yüklüydü ve negatif elektronlar tıpkı Güneş etrafında dönen gezegenler gibi bu çekirdeğin etrafında dönüyorlardı. Rutherford buna göre bazı bulgulara ulaştı;
- Altın tabakaya gönderilen ışınların büyük bir bölümü direkt olarak geçtiği için atomda büyük boşluklar vardır.
- Işınların küçük bir kısmı kırıldığı ve yansıdığı için atomdaki pozitif yükler çekirdekte toplanmıştır.
- Yükün büyüğü çekirdekte olduğu için atom kütlesi de çekirdekte toplanmıştır.
- Her bir atomda ne kadar pozitif tanecik varsa o kadar da negatif tanecik vardır.
- Pozitif tanecikler çekirdekte toplanmıştır, elektronlar ise çekirdek etrafında dönmektedir.
- Elektronlar tek bir noktada toplanmadıkları için atom hacminin büyük biri bölümünü kaplarlar.
Rutherford atom modeli, dönemine göre oldukça başarılı bir fiziksel model ortaya koydu. Hatta pek çok modele de ilham oldu ancak maalesef atomun önemli yapı taşlarından olan nötronu içermiyordu. Aynı şekilde elektronların hareketlerini de doğru bir şekilde açıklayamamıştı. Basitçe, Güneş Sistemi’nin bir atomda da geçerli olduğunu ortaya atmıştır.
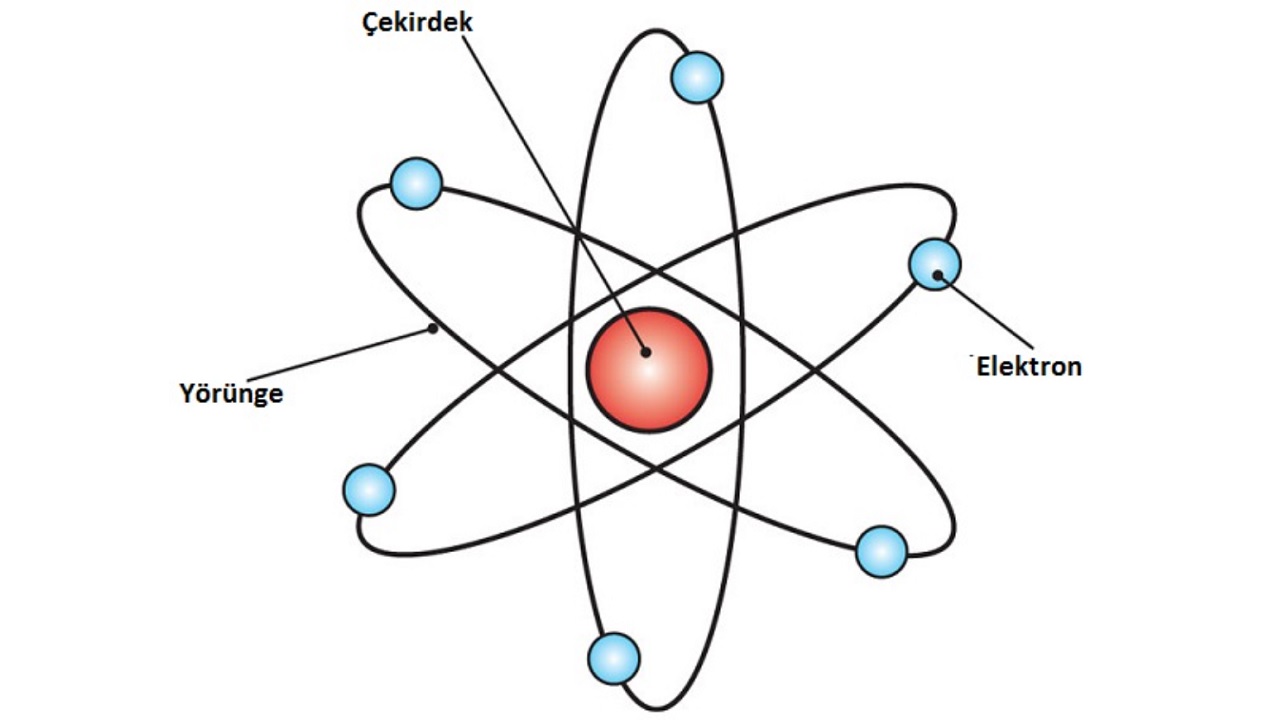
Rutherford atom modelinden ilham alan Bohr atom modeli:
Bohr atom modeli, Rutherford atom modeli ile aynı yıl 1911’de; 1922 yılında Nobel Fizik Ödülü sahibi olacak olan Danimarkalı fizikçi Niels Henrik David Bohr tarafından ortaya atılmıştır. Rutherford atom modeli ve öncesinde ortaya atılan teorilerden farklı olarak Bohr, atom içindeki elektronların hareketini inceledi ve açıkladı. Bohr atom modeline göre;
- Çekirdekten belirli uzaklıktaki bir mesafede hareket eden elektronların kararlı halinin sabit bir enerjisi vardır.
- Elektronların kararlı hareketi dairesel bir yörünge çizer.
- Kararlı halde bulunan elektron, radyasyon yaymaz.
- Yüksek enerji seviyesinden düşük enerji seviyesine düşen bir elektron, değişen seviye farkına eşit bir ışık kuantı yayar.
- Atoma yalnızca klasik fizik çerçevesinden yaklaşmıştır.
- Yalnızca tek elektronlu atomları açıklayabilir.
- Dalga - parçacık ikiliğini göz ardı etmiştir.
- Heisenberg belirsizlik ilkesine göre elektronların oluşturduğunu iddia ettiği yörünge tanımı yanlıştır.
- Nötrondan bahsetmez.
- Atom ve molekül arası bağı açıklamak için yetersizdir.
 Türkiye'nin en güncel forumlardan olan forumdas.com.tr'de forumda aktif ve katkısı olabilecek kişilerden gönüllü katkıda sağlayabilecek kişiler aranmaktadır.
Türkiye'nin en güncel forumlardan olan forumdas.com.tr'de forumda aktif ve katkısı olabilecek kişilerden gönüllü katkıda sağlayabilecek kişiler aranmaktadır.

